初中化学知识点总结
大部分酸及酸性氧化物能溶于水,(酸性氧化物+水→酸)大部分碱性氧化物不溶于水,能溶的有:氧化钡、氧化钾、氧化钙、氧化钠(碱性氧化物+水→碱)。
向三只*中分别滴加Ba(NO3)2溶液,若产生白色沉淀,则是稀H2SO4;再分别滴加AgNO3溶液,若产生白色沉淀则是稀HCl,剩下的是稀HNO3。
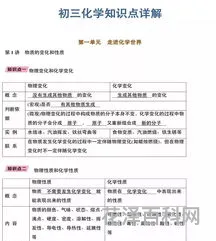
溶于水的碱有:氢氧化钡、氢氧化钾、氢氧化钙、氢氧化钠和氨水,其他碱不溶于水。难溶性碱中Fe(OH)3是红褐色沉淀,Cu(OH)2是蓝色沉淀,其他难溶性碱为白色。(包括Fe(OH)2)注意:沉淀物中AgCl和BaSO4不溶于稀硝酸。
检验NaOH中是否含有NaCl:先滴加足量稀硝酸,再滴加AgNO3溶液,若产生白色沉淀,则含有NaCl。
氢气:在玻璃尖嘴点燃气体,罩一干冷小烧杯,观察杯壁是否有水滴,往烧杯中倒入澄清的石灰水,若不变浑浊,则是氢气。
中考化学重点归纳笔记
例如:c2h5oh中的oh是羟基,不会电离出来;硫*中有两个oh也是羟基,众所周知,硫*不可能电离出oh-的。而在naoh、mg(oh)2、fe(oh)3、cu2(oh)2co3中的oh就是离子,能电离出来,因此这里叫*氧根。
读数时量筒必须放平稳,视线与凹液面的最低处保持水平【读数时若仰视,则读数偏低;读数时若俯视,则读数偏高——倒液体时仰视,则量取的液体偏多;倒液体时俯视,则量取的液体偏少】。
从常见的强碱naoh、koh、ca(oh)2和常见的弱碱fe(oh)3、cu(oh)2来看,似乎易溶于水的碱都是强碱,难溶于水的碱都是弱碱。
用排水法收集氧气时,当导管口刚产生气泡时,不宜立即收集,待导管口有连续均匀气泡放出时再收集。因为开始的气泡是空气,若此时收集氧气不纯。
催化剂:在化学反应里能改变其它物质的化学反应速率,而本身的质量和化学*质在化学反应前后都没有变化的物质。(又叫触媒)
初中化学公式总结大全
众所周知,fecl3溶液是黄*的,但是不是意味着fe3+就是黄*的呢?不是。fe3+对应的碱fe(oh)3是弱碱,它和强*根离子结合成的盐类
如:2nh4cl+ca(oh)2=△=cacl2+2nh3↑+2h2o,这条方程式全部都不能拆,因此不能写成离子方程式。有的方程式要看具体的反应
多元*究竟能电离多少个h+,是要看它结构中有多少个羟基,非羟基的*是不能电离出来的。如亚**(h3po3),看上去它有三个h,好像是三元*,
为很弱的碱。其实不然,通过测定agno3溶液的ph值近中*,也可得知agoh也是一中强碱。2005-10-39:58:00西部化雪








添加新评论